- Главная
- Здравые решения
- Как выбрать таблетки для похудения
- Результаты лечения бесплодия у больных с избыточной массой тела
Результаты лечения бесплодия у больных с избыточной массой тела
Авторы: И.В. Кузнецова, Д.О. Санта-Мария Фернандес, В.М. Михаелянц. Кафедра акушерства и гинекологии (зав. - проф. Н.М.Подзолкова) РМАПО, Москва
Опубликовано: Результаты лечения бесплодия у больны х с избыточной массой тела // Гинекология, Том 8 № 2. – с. 30-33.
Ожирение и избыточная масса тела относятся к числу патологических состояний, значительно осложняющих течение эндокринных гинекологических заболеваний и снижающих эффективность их лечения. Ожирение широко распространено в популяции, а частота нарушений менструальной функции у женщин, имеющих избыточную массу тела, достигает 70% [1].
В настоящее время ожирение рассматривается как хроническое заболевание, характеризующееся комплексом метаболических расстройств, которые в свою очередь могут стать основой либо поддерживать нарушения функций репродуктивной системы. Основными тенденциями в развитии этих нарушений становятся гиперандрогения, ановуляция и формирование поликистозных яичников [1, 2].
Лечение ожирения представляет собой трудновыполнимую задачу. Несмотря на то что уменьшение массы тела является залогом улучшения метаболических и эндокринных процессов, добиться нормализации массы тела для большинства больных оказывается недостижимой целью. Поэтому вопрос о лечении эндокринных нарушений, в том числе о стимуляции овуляции при эндокринном бесплодии, приходится решать, не дожидаясь полной нормализации антропометрических и метаболических показателей.
В настоящее время с целью коррекции массы тела и параметров углеводного и жирового обмена применяются различные препараты, на фоне использования которых возможно восстановление регулярных менструаций и спонтанное наступление беременности. Применение лекарственных средств, улучшающих чувствительность тканей к инсулину, считается одним из базовых методов лечения синдрома поликистозных яичников (СПКЯ), часто сочетающегося с избытком массы тела [3]. Но добиться желаемого уменьшения массы тела с помощью монотерапии инсулиносенситайзерами невозможно, в то время как именно уменьшение количества жировой ткани - основной метод нормализации метаболических показателей, в том числе снижения инсулинорезистентности. Поэтому при ожирении очевидна необходимость назначения препаратов, позволяющих снизить массу тела эффективнее и быстрее, чем это достигается при соблюдении только диеты [4].
Остается открытым вопрос о целесообразности назначения указанных лекарственных средств на фоне проведения индукции овуляции. Целью настоящего исследования явилась оценка эффективности совместного применения непрямых индукторов овуляции и препаратов, улучшающих метаболические показатели, у женщин с эндокринным бесплодием на фоне ожирения.
Материалы и методы
Обследованы 38 женщин 23-37 лет с ожирением/избыточной массой тела и подтвержденным эндокринным бесплодием. Из исследования исключены пациентки с некомпенсированными нарушениями функции щитовидной железы, гиперпролактинемией и неклассическими формами врожденной гиперплазии коры надпочечников.
Пациентки были разделены на 2 группы по 19 человек, сопоставимые по возрасту, клиническим и лабораторным параметрам. В течение 4 мес до начала индукции овуляции женщинам обеих групп было проведено лечение, направленное на нормализацию массы тела и метаболических показателей с помощью комплексной терапии препаратами Метформин в суточной дозе 1000-1500 мг и Ксеникал (орлистат, «Ф. Хоффманн Ля Рош», Швейцария) в суточной дозе 360 мг. Далее пациенткам группы 1 (основная) назначали непрямую индукцию овуляции при продолжении приема указанных препаратов, а группы 2 (сравнения) индукцию овуляции проводили после прекращения приема указанных препаратов.
С целью непрямой индукции овуляции использовали кломифена цитрат в дозировке 50-100-150 мг. Кломифен назначали в дозе 50 мг в течение 5 дней с 3-5-го дня цикла. Дозу кломифена увеличивали при отсутствии овуляторного ответа на 50 мг в каждом последующем цикле до максимальной дозы 200 мг. Длительность приема кломифена не превышала 6 циклов.
Обследование пациенток производили до начала лечения, перед стимуляцией овуляции и на фоне стимуляции.
Оценивали в динамике:
- антропометрические показатели (масса тела, индекс массы тела - ИМТ), отношение окружности талии к окружности бедер - ОТ/ОБ;
- параметры углеводного и жирового обмена (глюкоза натощак и через 2 ч после стандартной нагрузки, общий холестерин - ОХС, холестерин липопротеидов высокой плотности - ХС ЛПВП, холестерин липопротеидов низкой плотности - ХС ЛПНП, триглицериды -ТГ);
- уровень пептидных и стероидных гормонов: лютеинизирующий и фолликулостимулирующий гормоны (ЛГ и ФСГ), тестостерон, андростендион, эстрадиол, иммунореактивный инсулин (ИРИ) натощак и через 2 ч после стандартной нагрузки глюкозой, а также половые стероиды связывающего глобулина (ПССГ) методом РИА;
- состояние органов малого таза методом трансвагинального ультразвукового сканирования на аппарате "Aloka SSD-2000" с использованием датчика с частотой 7,5 мГц;
- овуляторный ответ с помощью измерения прогестерона плазмы и УЗИ.
Статистическую обработку данных осуществляли по общепринятым методикам с использованием компьютерных программ Microsoft Exel, "Biostat", "STATISTICA 6.0 for Windows". Проводили определение среднего показателя (М), ошибки средней величины (m). Применяли параметрические методы (дисперсионный анализ и парный критерий Стьюдента) и непараметрические методы Манна-Уитни, Вилкоксона, Крускала-Уоллиса, Даннета. Достоверными различия принимали при уровне значимости 0,05.
Результаты
Основной жалобой обследованных пациенток было бесплодие (100%). Нарушения менструального цикла до проведения лечения также отмечены у всех пациенток, в 28 (73,7%) наблюдениях нарушения менструального цикла носили характер олигоменореи, в 10 (26,3%) - ациклических кровотечений. Средний возраст составил 29,3±2,6 года, средняя длительность бесплодия -5,0±2,4 года.
В процессе лечения на фоне соблюдения диеты и приема препаратов, улучшающих показатели жирового и углеводного обмена, достигнуто снижения массы тела в среднем на 13,4±3%. К концу 4-го месяца коррекции массы тела и метаболических показателей клинический эффект, выражавшийся в нормализации ритма менструаций, наблюдался у 27 (71,1%) больных. У 13 (34,2%) самостоятельно восстановилась овуляция с сохранением недостаточности лютеиновой фазы (уровень прогестерона в повторных образцах менее 30 нмоль/л). Характеристика клинических и лабораторных показателей до и после первого этапа лечения в группах представлена в табл. 1, 2.
Несмотря на достоверное улучшение антропометрических показателей, средние показатели массы тела, ИМТ и ОТ/ОБ выходили за пределы нормальных значений (см. табл. 1). Но наблюдаемый клинический эффект (нормализация ритма менструаций у большинства больных) и существенный процент снижения массы тела, который расценивается как значимый с позиций коррекции метаболических нарушений, позволили нам ограничиться 4-месячным циклом лечения перед началом стимуляции овуляции.
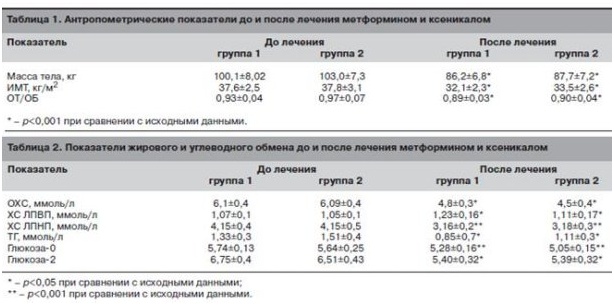
На фоне улучшения антропометрических показателей наблюдали положительную динамику параметров жирового и углеводного обмена (см. табл. 2).
Достоверное улучшение характеризовало все показатели жирового и углеводного обмена. В то же время отмечено снижение концентрации ИРИ натощак и через 2 ч после стандартной нагрузки глюкозой (табл. 3), что в совокупности с положительной динамикой метаболических параметров отражает снижение степени инсулинорезистентности у обследованных больных.
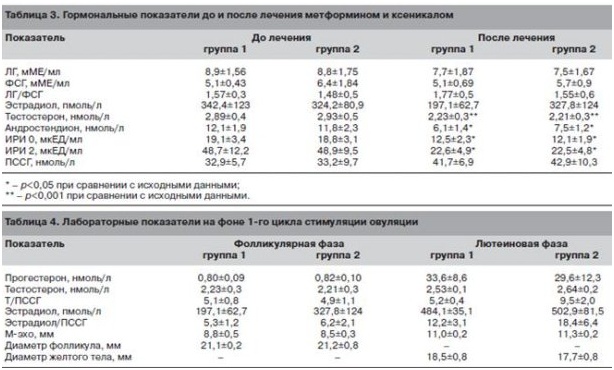
Анализ гормонального профиля позволил выявить достоверное снижение уровня основных яичниковых андрогенов (андростендион и тестостерон), что, очевидно, и создало условия для нормализации менструального ритма и спонтанного восстановления овуляции у части больных.
Перед началом индукции овуляции больные были разделены на две группы, причем отсутствовали различия по возрастным, клиническим, антропометрическим, метаболическим и гормональным характеристикам. В целом при использовании кломифена овуляция была достигнута в 31 (81,6%) случае, беременность наступила у 20 (52,6%) пациенток В группе 1 беременность наступила у 15 (78,9%) больных, в группе 2 - у 5 (26,3%) пациенток (/КО,05).
Овуляция с полноценной лютеиновой фазой наступила после 1,6±0,7 цикла стимуляции в группе 1 и после 2,5±0,9 цикла стимуляции в группе 2.
Толщина эндометрия, средние размеры доминантного фолликула в конце фолликулярной фазы не различались, так же как и средние размеры желтого тела в овуляторных циклах (табл. 4).
Также не было обнаружено достоверных отличий в уровне половых гормонов на фоне индукции овуляции. Однако в группе женщин, прекративших прием корректоров метаболизма, наблюдали тенденцию к повышению уровня тестостерона в лютеиновую фазу цикла наряду со снижением концентрации ПССГ. В совокупности эти тенденции привели к достоверному повышению индекса свободных андрогенов в лютеиновую фазу цикла у больных группы 2 по сравнению с группой 1 (p<0,001).
Нечувствительными к кломифену были 7 (18,4%) больных. Клинико-лабораторные особенности этой группы пациенток характеризовались достоверным (p<0,05) увеличением объема яичников (10,6±0,9 см3) по сравнению с кломифенчувствительными больными (8,81±0,6 см3). Достоверных отличий по уровням андростендиона и ФСГ между пациентками, отвечающими и не отвечающими на кломифен, обнаружено не было; однако уровни ЛГ (16,5±1,6 мМЕ/л) и тестостерона (3,4±0,8 нмоль/л) были достоверно выше (p<0,05) у женщин, нечувствительных к кломифену, чем в целом по группе.
Обсуждение
Ожирение влияет на чувствительность тканей к инсулину, стероидогенез и продукцию гонадотропинов, нарушая в результате овуляторную функцию яичников. Коррекция массы тела и показателей метаболизма составляет основу лечения репродуктивной дисфункции у больных с ожирением и часто позволяет добиться спонтанного восстановления менструального цикла [2, 5]. Женщины с ановуляторным бесплодием демонстрируют меньшую чувствительность к различным методам стимуляции овуляции при наличии избыточной массы тела [6, 7]. Хотя резистентность к кломифену не зависит от степени ожирения, доза кломифена, требуемая для эффективной индукции овуляции, оказывается выше у женщин с избытком массы тела [8]. Следовательно, снижение массы тела необходимо перед проведением мероприятий, непосредственно направленных на восстановление фертильности, а стабильность массы тела на фоне проведения стимуляции овуляции является одним из факторов, обеспечивающих эффект восстановления фертильности. Такие лабораторные признаки, как повышенный уровень ЛГ, тестостерона, большое количество мелких фолликулов, увеличение объема яичников, давно рассматриваются как прогностически неблагоприятный фактор, отражающий снижение чувствительности к кломифену при СПКЯ [9]. Наше исследование также продемонстрировало зависимость ответа репродуктивной системы на стимуляцию овуляции от перечисленных показателей. Учитывая тот факт, что коррекция массы тела и метаболических нарушений приводит к снижению концентрации ЛГ и яичниковых андрогенов, а также уменьшению объема яичников, следует признать необходимость и обоснованность проведения лечения ксеникалом и метформином перед индукцией овуляции у женщин с ожирением. Известно, что применение метформина у больных СПКЯ повышает эффективность стимуляции кломифеном [3, 10]. Поскольку патогенез нарушений менструальной функции у женщин с СПКЯ и другими формами овуляторной дисфункции яичников на фоне ожирения совпадает, следует ожидать положительного эффекта применения метформина у женщин с избыточной массой тела. Проведенное нами ранее исследование показало, что частота наступления беременности при совместном использовании кломифена и метформина увеличивалась, но это увеличение не было статистически достоверным [11]. Анализируя полученные данные, мы убедились, что причиной недостаточного эффекта индукции овуляции оказалась высокая масса тела (ИМТ>30 кг/м2). Известно, что метформин не относится к препаратам для лечения ожирения, что и обусловливает его недостаточную эффективность у больных с избыточным весом и ожирением. Сравнение метформина и препарата Ксеникал с позиций влияния на массу тела демонстрирует несомненные преимущества последнего при сходных позитивных изменениях параметров метаболизма у больных с СПКЯ [12]. Именно это явилось основанием для назначения препарата Ксеникал, позволяющего эффективно контролировать массу тела и улучшать показатели углеводного и жирового обмена.
Наше исследование позволяет утверждать обоснованность проведения стимуляции овуляции на фоне применения Ксеникала и метформина. Обращает на себя внимание то обстоятельство, что уже в первом цикле стимуляции индекс свободных андрогенов в лютеиновую фазу цикла оказался достоверно выше у женщин, прекративших прием данных препаратов. По-видимому, возобновление метаболических нарушений после отмены указанных препаратов влечет за собой усиление андрогенного биосинтеза и снижает частоту овуляторных циклов. Клинические данные подтверждают эту предпосылку: среднее количество циклов, требовавшихся для достижения овуляции, оказалось ниже, а частота наступления беременности достоверно выше в группе женщин, продолживших прием метформина и орлистата на фоне стимуляции овуляции.
Для повышения эффективности непрямой индукции овуляции целесообразно выявлять женщин с потенциально низкой чувствительностью к кломифену. В случае сохранения высокого уровня яичниковых андрогенов после подготовительного этапа в совокупности с высоким уровнем ЛГ и большим объемом яичников целесообразно решать вопрос о других методах восстановления фертильности. Однако проблема резистентности к кломифену у женщин с ожирением требует дальнейшего изучения.
Таким образом, успех консервативного лечения бесплодия при ожирении определяется, среди прочих факторов, адекватной коррекцией метаболических нарушений перед стимуляцией овуляции. С этой целью может использоваться комплексное лечение, включающее препараты Ксеникал и метформин. Показанием для назначения метформина является клинически и лабораторно подтвержденная инсулинорезистентность. Но у женщин с ожирением терапия метформином не позволяет достичь желаемого эффекта ввиду сохранения негативного влияния избытка жировой ткани на метаболизм и гормональный гомеостаз. Снижение массы тела на 10% и более от исходного показателя является чрезвычайно важным компонентом лечения. Необходимость быстрого достижения коррекции массы тела у пациенток, планирующих беременность, обусловлена возрастными особенностями функций репродуктивной системы в условиях эндокринопатий: снижение потенциала фертильности у данной категории больных происходит раньше, чем в популяции. Следовательно, оптимизация лечения предполагает назначение препарата Ксеникал как препарата, позволяющего добиться снижения массы тела и нормализации метаболических показателей в короткие сроки. Продолжение его приема на фоне индукции овуляции повышает эффективность данного метода и способствует восстановлению фертильности.
Литература
- Ожирение: этиология, патогенез, клинические аспекты. Под ред. ИИДедова, ГАМельниченко. М: МИА, 2004
- Тиканова ВВ. Автореф. дис. канд. мед. наук. М, 2005.
- BarbieriRL, GargiuloAR. Minerva Ginecol2004; 56: 63-794.
- Петунина НА. Гинекология. 2002; 4 (1): 32-5.
- Прилепская ВН. Гинекология. 2002; 4 (1): 30-2.
- Дуринян ЭР, Назаренко ТА, Чечурова ТН. Новые горизонты гинекологической эндокринологии. Сб. тезисов, М., 2002.
- Baird DT, Anderson RA. In: Androgen disorders in women/Ed. RAzziz, JENestler, DDewailly. Philadelphia: Lippincott-Raven Publ, 1997; 747-63.
- Galtier-Dereure F et al. Hum Reprod 1997; 12 (Suppl. 1): 88-96.
- Ficicioglu C, Api M, Ozden S. Acta Obstet Gynecol Scand 1996; 75 (10): 917-21.
- Ajossa S et al. Minerva Ginecol 2004; 56: 15-26.
- Кузнецова ИВ., Черемньх А.Ю. Новые горизонты гинекологической эндокринологии. Сб. тезисов. М 2002.
- Jayagopal V et al. J Clin Endocrinol Metab 2004; 10:2004-176.
UA.XEN.14.010
Опубликовано при поддержке ООО «Рош Украина»
- Комплексное лечение простой гиперплазии эндометрия у женщин репродуктивного возраста, страдающих ожи
- Патогенетические аспекты ожирения и нарушения репродуктивной функции женщины
- Лишний вес после родов
- Все о Ксеникале
- Таблетки для похудения: отзывы
- Как безопасно и эффективно снизить массу тела: таблетки для похудения
- Таблетки для похудения: не навреди!
- Таблетки для похудения и эффективность
- Таблетки для похудения: похудение без диеты?
- Таблетки для похудения: как достигается снижение веса?
- Таблетки для похудения: лучший способ похудеть?
- Как выбрать таблетки для похудения
